

近日,ACS Catalysis在线发表了山东理工大学生命与医药学院高秀珍/马钦元团队的研究成果“Functional Studies on an Indel Loop between the Subtypes of meso-Diaminopimelate Dehydrogenase”。山东理工大学马钦元副教授及2020级硕士研究生王笑笑为论文共同第一作者,高秀珍副教授为论文通讯作者。
D-氨基酸广泛应用于食品、医药、化妆品等领域,但其在自然界中存在较少。内消旋-二氨基庚二酸脱氢酶(meso-DAPDH)因其能一步催化酮酸合成D-氨基酸而受到广泛关注。前期作者对该酶进行系统发育进化分析和底物谱分析发现该酶家族存在趋异进化,两个亚类在不对称还原氨化2-酮酸生成D-氨基酸上呈现明显的差异。在对两个亚类进行氨基酸序列分析时发现,两者之间存在明显的缺失/插入序列,其中最长的一段缺失/插入序列包含16个氨基酸,以loop的形式存在于亚类I中,命名为indel loop,目前该结构的功能尚未被报道。
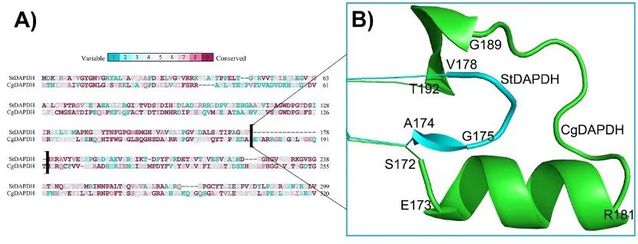
图1 以亚类I的代表酶种CgDAPDH和亚类II的代表酶种StDAPDH显示的meso-DAPDH中的插入/缺失序列。
为此,本研究设定了两个目的:(1)研究本段indel loop在CgDAPDH催化中的作用;(2)研究本段indel loop与亚类间不对称还原氨化活性差异之间的关系。
首先,以亚类I的代表酶种CgDAPDH为研究对象,通过构建氨基酸缺失突变体、丙氨酸突变体确定了本段indel loop在CgDAPDH催化中至关重要的作用,其中R180A的活性几乎完全丧失。分子动力学模拟显示,R180位点的R替换成A之后,R180与E262之间的氢键消失。该相互作用的变化导致了Y219、H152和D90之间形成的“力的三角形”失衡,同时,在H152和Q167之间形成的氢键综合作用下,催化残基H152的咪唑环发生了约180°翻转。
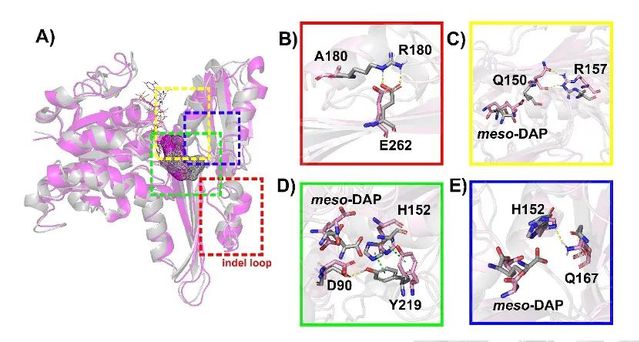
图2CgDAPDH野生型及突变体R180A的分子动力学模拟分析
随后,鉴于该段indel loop与其侧翼氨基酸L176和H193之间形成的氢键相互作用力网络,作者构建了L176A和H193A突变体以研究indel loop与侧翼氨基酸形成的氢键网络对蛋白催化功能的影响,进一步确定其在CgDAPDH催化中的关键作用。两个丙氨酸突变的kcat/Km相对野生型损失了86%和94%。MD结果及进一步分析表明了该氢键网络的破坏导致整个蛋白氨基酸侧链之间氢键网络重排,由此,作者提出了该段indel loop在CgDAPDH催化中的“地基”作用。
最后,作者以亚类II的代表酶种StDAPDH为研究对象,将CgDAPDH中的这段氨基酸序列以两个氨基酸为单位,步进式插入到StDAPDH中,构建了一系列插入突变体,分析其对氧化脱氨及还原氨化活性的影响。动力学参数分析表明,氨基酸插入影响了StDAPDH的整体催化活性,但是对还原氨化活性的破坏力更大。对野生型StDAPDH和插入完整loop的突变体St+N16进行随机加速分子动力学模拟,发现该段loop位于产物释放通道附近,脱氨和氨化采用了不同的解离路径,在StDAPDH中插入氨基酸序列之后,脱氨方向解离通道封闭。
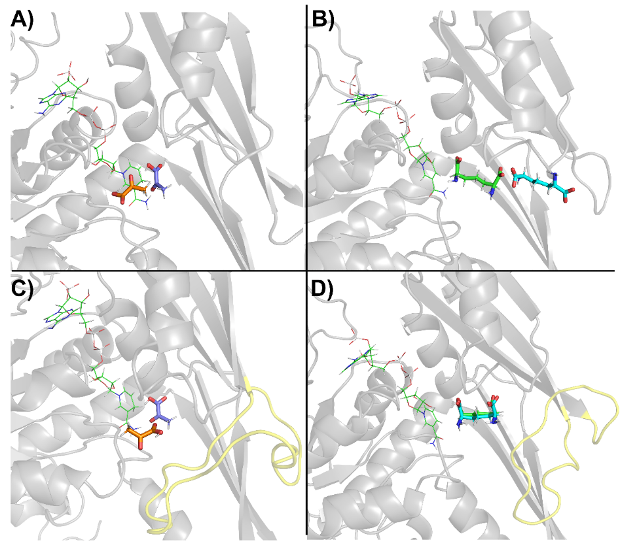
图3 底物从结合口袋的释放路径
总之,该论文首次解析了meso-DAPDH家族中一段关键插入/缺失序列的作用及机制。该研究同时揭示了氧化脱氨和还原氨化两个方向在产物释放通道上的差异,为后续开展催化机理的解析及蛋白质工程改造提供了新的思路。
来源:遇见生物合成

地址:山东省淄博市张店区新村西路266号 电话:0533-2786123 传真:0533-2780944 E-mail:oice@sdut.edu.cn
版权所有:山东理工大学 国际交流合作处